新型冠状病毒抗原检测试剂盒(以下简称新冠病毒试剂盒)主要通过荧光PCR技术,检测被采集对象的咽拭子、血液等样本中的病毒遗传物质的含量,以帮助快速筛查疑似新冠病毒感染者,是当前进行新冠病例筛查的主要检测手段。
新冠病毒试剂盒的出口需要哪些步骤和注意事项,请和小编一起来学习一下吧!
一、新冠病毒试剂盒出境卫生检疫
(https://customs.chinaport.gov.cn/tswpwebserver/tswp/view/homepage)向所在地直属海关提出申请。
3.凭借《特殊物品卫生检疫审批单》、发票、箱单、合同、委托书等资料进行报检。

二、新冠病毒试剂盒出口申报税号
根据海关总署《2020年第118号公告》,新冠病毒试剂盒的名称为“新型冠状病毒(COVID-19)检测试剂盒”,商品编号为“38221900.20”,原编号“30021500.50”、“38220010.20”及“38220090.20”停止使用,成交计量单位按照“人份”申报,代码为“170”。
第一种情况:
产品已取得我国医疗器械产品注册证,符合进口国(地区)的质量标准要求。
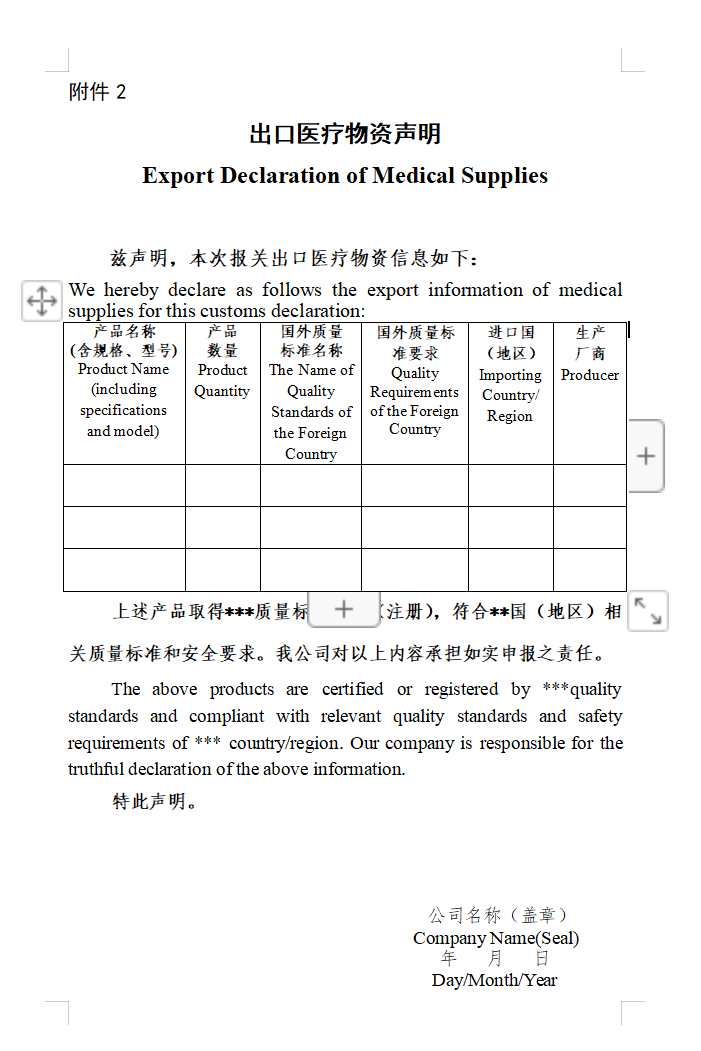
根据《关于有序开展医疗物资出口的公告》(商务部 海关总署 国家药品监督管理局公告2020年第5号)规定,出口新冠病毒试剂盒的企业向海关报关时,须提供书面或电子声明,承诺出口产品已取得我国医疗器械产品注册证,符合进口国(地区)的质量标准要求,海关凭药品监督管理部门批准的医疗器械产品注册证验放。


第二种情况:
产品取得国外标准认证或注册
根据《关于进一步加强防疫物资出口质量监管的公告》(商务部 海关总署 国家市场监督管理总局公告2020年第12号)规定,产品取得国外标准认证或注册的新冠病毒试剂盒出口企业,报关时须提交电子或书面声明,承诺产品符合进口国(地区)质量标准和安全要求,海关凭商务部提供的国外标准认证或注册的生产企业清单验放。(清单在中国医药保健品进出口商会网站动态更新)

四、特殊贸易方式下新冠病毒试剂盒出口的处理

一些特殊的贸易方式下,如对外承包工程,新冠病毒试剂盒出口的证件要求参照一般贸易出口方式执行。


